Le prix des médicaments
Fiche pratique J 360
En 2019, le chiffre d’affaires des médicaments en France est de 60 milliards d’euros selon le Bilan Economique édition 2020 du LEEM (Les entreprises du médicament, syndicat du milieu pharmaceutique). Environ 30 milliards d’euros de ce chiffre d’affaires sont réalisés à l’export. L’autre moitié se répartit entre la vente de médicaments aux officines (pharmacies) et aux hôpitaux : 21,7 milliards d’euros sont réalisés par la vente aux officines en France métropolitaine (21,2 milliards dont 19,3 milliards sur des médicaments remboursables et 1,9 milliard sur des médicaments non remboursables) et dans les DOM (0,5 milliard), 8,4 milliards d’euros sont réalisés par la vente aux hôpitaux.

Quels sont les processus de mise sur le marché d’un médicament ? Quel circuit administratif suivent les médicaments ? Comment est déterminé le prix d’un médicament ? Comment décide-t-on si un médicament est remboursé par la Sécurité sociale ou non ?
L’Institut national de la consommation vous répond.
1 - Qu'est-ce qu'un médicament ?
2 - Comment se passe la mise sur le marché d'un médicament ?
2.1 - La phase de recherches et d'essais cliniques
2.2 - L'autorisation de mise sur le marché
2.3 - L'autorisation temporaire d'utilisation
2.4 - La recommandatoin temporaire d'utilisation
3 - Comment est déterminé le prix d'un médicament ?
3.1 - Le prix d'un médicament sans demande de remboursement par le laboratoire
3.2 - Le prix d'un médicament avec demande de remboursement par le laboratoire
3.3 - Le prix des médicaments génériques
3.4 - Les marges des grossistes et des pharmacies, et les taxes
3.5 - Schéma récapitulatif du circuit administratif d'un médicament
3.6 - La décomposition du prix public d'un médicament
4 - Où acheter ses médicaments ?
1 – Qu’est-ce qu’un médicament ?
L’article L.5111-1 du code de la santé publique définit un médicament de la façon suivante : "toute substance ou composition présentée comme possédant des propriétés curatives ou préventives à l'égard des maladies humaines ou animales, ainsi que toute substance ou composition pouvant être utilisée chez l'homme ou chez l'animal ou pouvant leur être administrée, en vue d'établir un diagnostic médical ou de restaurer, corriger ou modifier leurs fonctions physiologiques en exerçant une action pharmacologique, immunologique ou métabolique".
Pour faire plus simple, un médicament est donc un produit fabriqué dans le but de soigner, de diagnostiquer ou de prévenir une maladie. Un médicament peut prendre plusieurs formes : comprimé, injection, solution buvable, pommade, etc.
Un médicament contient forcément un principe actif et des excipients. Le principe actif est une substance d’origine naturelle ou chimique qui a une action curative ou préventive précise dans l’organisme. Autrement dit, il s’agit de la substance qui "soigne".
Les excipients sont des substances d’origine naturelle ou chimique qui servent à faire parvenir le principe actif dans l’organisme à l’endroit où il doit agir, mais qui n’ont pas d’effet curatif ou préventif. Ils facilitent l’utilisation du médicament et assurent sa stabilité dans l’organisme. Les excipients agissent sur l’aspect, le conditionnement, la couleur et le goût du médicament.
|
La différence entre un médicament princeps et un médicament générique
Le mot "princeps" vient du latin qui veut dire "le premier dans le temps ou dans l’ordre". Un médicament princeps, également appelé "médicament de référence" ou "médicament de marque", est donc un nouveau médicament. Les médicaments princeps sont protégés par des brevets.
Une fois que le brevet tombe dans le domaine public, la composition en principes actifs du nouveau médicament devient donc publique. Il devient donc possible de créer des copies de ce nouveau médicament : c’est ce qu’on appelle un médicament générique.
Il est fabriqué à partir de la même composition en principes actifs, doit avoir la même forme pharmaceutique que le princeps (comprimé, pommade, etc.) et se comporte de la même façon dans l’organisme que le princeps (on parle de bioéquivalence). La seule différence est au niveau des excipients qui peuvent être différents de ceux du médicament de référence, à condition que cela n’affecte pas la bioéquivalence du médicament générique par rapport au princeps.
Un médicament générique a donc la même efficacité qu’un princeps. De plus, avec la levée du brevet, les coûts de recherche sont réduits à zéro, le générique est alors bien moins cher (voir partie 3.3 sur la détermination du prix d’un médicament générique). |
2 – Comment se passe la mise sur le marché d’un médicament ?
2.1 - La phase de recherches et d’essais cliniques
Lorsqu’une nouvelle maladie arrive, les laboratoires de recherche pharmaceutiques se lancent dans la recherche parmi des milliers de molécules afin de trouver celle ou celles qui auront un intérêt thérapeutique, c’est-à-dire qui peuvent soigner la maladie en question.
Les molécules retenues sont ensuite testées en laboratoire afin d’évaluer leurs effets et leur toxicité. Ces essais, généralement pratiqués sur des animaux sont appelés des essais précliniques. Après ces tests arrivent les phases d’essais cliniques impliquant la participation de personnes volontaires.
Les essais cliniques se déroulent en trois phases :
- Phase I : le médicament est essayé sur un nombre restreint de volontaires non porteurs de la maladie. Cette phase sert à évaluer la tolérance au médicament,
- Phase II : le médicament est administré sur un petit nombre de personnes porteuses de la maladie. Cette phase permet d’estimer la dose minimale nécessaire pour que le médicament soit efficace et d’observer les effets secondaires selon le dosage,
- Phase III : le médicament est donné à un grand nombre de patients et dure plusieurs années. Cette phase permet d’évaluer l’efficacité du médicament par rapport à un traitement de référence (s’il existe) et/ou à un placebo (quand aucun traitement n’existe). Elle permet aussi d’évaluer les risques potentiels du nouveau médicament. Elle permet finalement d’évaluer le rapport efficacité/tolérance.
![]() Les essais cliniques nécessitent un avis favorable du Comité de Protection des Personnes (CPP) et une autorisation délivrée par l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM).
Les essais cliniques nécessitent un avis favorable du Comité de Protection des Personnes (CPP) et une autorisation délivrée par l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM).
2.2 – L’autorisation de mise sur le marché
Ensuite, pour qu’un médicament soit commercialisable, le laboratoire pharmaceutique (le fabricant du médicament) doit obtenir une autorisation de mise sur le marché (AMM). La procédure d’autorisation de mise sur le marché d’un médicament est définie par les articles L. 5121-8 et suivant du code de la santé publique.
L’AMM est délivrée soit par l’Agence Nationale de Sécurité du Médicament et des produits de santé (ANSM) (au niveau national), soit par l’Agence Européenne du Médicament (au niveau européen), selon trois critères principaux (article L. 5121-9 du code de la santé publique) : la qualité, la sécurité et l’efficacité. Il est vérifié que :
- La composition du médicament correspond bien à ce que déclare le fabricant,
- Le médicament n’est pas nocif dans les conditions normales d’utilisation,
- Le médicament est au moins aussi efficace qu’un placebo ou qu’un autre médicament existant.
Pour effectuer cette évaluation, le laboratoire doit fournir un dossier comprenant des informations sur le médicament, son principe actif, les résultats des essais précliniques et cliniques. L’Agence s’appuie également sur des groupes d’experts pour cette expertise. C’est le directeur de l’Agence qui délivre finalement l’autorisation de mise sur le marché qui est ensuite publiée au Journal officiel. L’AMM est accompagnée du résumé des caractéristiques du produit (dénomination, composition, forme pharmaceutique, etc.), de la notice pour le patient et de l’étiquetage qui comprend notamment des informations nécessaires pour identifier le médicament.
L’AMM est délivrée pour une population cible, pour certaines pathologies. Autrement dit, le médicament ne peut pas être utilisé n’importe comment, pour traiter n’importe quelle maladie sur n’importe quel patient.
2.3 – L’autorisation temporaire d’utilisation
Pour favoriser un accès rapide à certains médicaments, concernant notamment des maladies graves lorsqu’il n’existe pas d’alternatives connues (par exemple les médicaments pour le sida, les cancers, certaines maladies neurologiques, etc.), l’autorisation temporaire d’utilisation (ATU) peut se substituer provisoirement à l’autorisation de mise sur le marché.
L’ATU peut être nominative lorsqu’elle n’est délivrée qu’à un seul malade, à la demande et sous la responsabilité du médecin prescripteur, ou elle peut être de cohorte, lorsqu’elle concerne un groupe de patients.
Une ATU est obligatoirement accompagnée d’un protocole d’utilisation thérapeutique validé entre l’ANSM et l’exploitant. Ce protocole permet le ciblage de la population cible ainsi que le cadrage des modalités de suivi et de recueil d’informations (sécurité, efficacité, effets indésirables, etc.).
2.4 – La recommandation temporaire d’utilisation
Une recommandation temporaire d’utilisation (RTU) est délivrée par l’ANSM pour des médicaments disposant déjà d’une AMM, mais qui sont prescrits en dehors de cadre de cette autorisation (en dehors de la population cible par exemple).
Une RTU est obligatoirement accompagnée d’un protocole d’utilisation thérapeutique qui propose un cadre d’utilisation hors AMM. Il définit notamment une nouvelle posologie, une nouvelle durée du traitement, la nouvelle population cible concernée, etc.
3 – Comment est déterminé le prix d’un médicament ?
La détermination du prix d’un médicament dépend en premier lieu si le laboratoire qui le commercialise souhaite qu’il soit remboursé par la Sécurité sociale ou non. Ensuite, si le laboratoire souhaite qu’il soit remboursé, le prix du médicament va dépendre du "service médical rendu" (dans le cas où il n’existe pas d’autre médicament pour la cible et la pathologie visées) ou de l’"amélioration du service médical rendu" (s’il s’agit d’un médicament pour "remplacer" un traitement déjà existant). Et enfin, prix d’un médicament va dépendre de s’il s’agit d’un princeps ou d’un médicament générique.
3.1 – Le prix du médicament sans demande de remboursement par le laboratoire
Lorsqu’un laboratoire décide de ne pas faire de demande de remboursement pour le médicament, à la suite de l’obtention d’autorisation de mise sur le marché, ce dernier peut fixer librement le prix du médicament. On parle ici du "prix fabricant hors taxes", c’est-à-dire sans les marges des distributeurs et des grossistes, des pharmaciens, et de la TVA.
En règle générale, le laboratoire fixe le prix du médicament afin que les revenus espérés de la vente du médicament couvrent les coûts de production et les coûts d’entrée sur le marché pour le médicament.
Les coûts de production représentent les coûts de recherche médicale pour la conception du médicament, ainsi que toutes les consommations intermédiaires pour le produire (matière première, énergie, etc.). Les coûts d’entrée sur le marché correspondent :
- Frais relatifs à l’évaluation par l’agence qui délivre l’autorisation de mise sur le marché,
- Frais de packaging,
- Frais de traduction (en règle générale, un médicament à destination à être vendu mondialement, ainsi il faut que ce qu’il y a d’inscrit sur chaque boîte et notice d’utilisation corresponde à la langue du pays où il est vendu) ;
- Frais de logistique et de distribution,
- Frais de promotion (à noter que seuls les médicaments non remboursables peuvent faire l’objet de publicité et être placés devant le comptoir du pharmacien en accès libre pour les clients).
- Etc.
Les revenus espérés vont dépendre :
- De la population cible,
- Du contexte épidémiologique,
- Des perspectives de diffusion du produit,
- Et bien sûr, du prix du médicament.
Ainsi, plus un médicament s’adresse à une cible étroite de patient, plus il nécessite un prix de vente élevé pour que le laboratoire arrive à rentabiliser les coûts de recherche.
Les marges appliquées au prix fabricant hors taxes sont également totalement libres pour les médicaments non soumis à un remboursement par la Sécurité sociale.
Il existe trois types de médicaments non remboursés dont le prix est librement fixé :
- les médicaments hors liste : ce sont des médicaments que l’on peut acquérir sans ordonnance, et qui, même s’ils sont prescrits par un médecin, ne seront pas remboursés. Ce sont les médicaments dits OTC "Over The Counter", c’est-à-dire qui sont devant le comptoir du pharmacien et en accès libre,
- les produits sur liste : ce sont des médicaments à prescription obligatoire (obligation d’avoir une ordonnance pour les obtenir) mais non remboursés,
- les versions OTC de produits sur liste et remboursables.
La liberté dont bénéficient les fabricants quant à la fixation du prix des médicaments non remboursables explique les importantes variations de prix constatées d’une pharmacie à l’autre. Certaines pharmacies négocient directement le prix de vente de produits avec les fabricants : en s’engageant à vendre une certaine quantité d’un médicament pendant l’année, l’officine peut obtenir en échange une réduction du prix de vente concédée par le laboratoire.
Le taux de TVA sur les médicaments non remboursables est de 10 %.
3.2 – Le prix du médicament avec une demande de remboursement par le laboratoire
L’article L. 162-16-4 du code de la sécurité sociale détermine les règles de la fixation du prix des médicaments remboursables. Le prix va dépendre de quatre critères principaux : le niveau d’amélioration du service médical rendu, le prix des médicaments à même visée thérapeutique déjà disponibles sur le marché, le volume des ventes prévues ou constatées ainsi que les conditions prévisibles et réelles d’utilisation du médicament.
Pour que le médicament soit remboursé après avoir obtenu son autorisation de mise sur le marché, le laboratoire doit faire une demande auprès de la Haute Autorité de Santé. Cette dernière met en place la Commission de Transparence, composée de vingt professionnels de santé, un représentant d’associations de malades et d’usagers du système de santé (et leurs suppléants).
La Commission de Transparence va remettre un avis contenant le service médical rendu par le médicament, la liste des produits existants auxquels le produit peut être comparé, l’amélioration du service médical rendu par rapport aux thérapeutiques existantes, la population "cible" (la population concernée par les différentes indications du produit).
Le service médical rendu (SMR)
Le service médical rendu (SMR) est un critère absolu qui prend en compte :
- l’efficacité et les effets indésirables du médicament,
- la gravité de l’affection à laquelle il est destiné,
- le caractère préventif, curatif ou symptomatique du traitement,
- l’intérêt pour la santé publique du médicament.
Le SMR obtient ensuite une note allant de 1 à 4 qui va orienter le taux de remboursement :
L’amélioration du service médical rendu (ASMR)
L’amélioration du service médical rendu (ASMR) est une note relative présentant la valeur ajoutée du médicament par rapport aux traitements existants. Cette valeur ajoutée est notamment mesurée par l’efficacité du nouveau traitement et la tolérance (effets secondaires indésirables). L’ASMR obtient ensuite une note allant de 1 à 5 :
- 5 : amélioration insuffisante
- 4 : faible amélioration
- 3 : amélioration modérée
- 2 : amélioration importante
- 1 : amélioration majeure
Si un médicament présente un progrès par rapport aux autres produits existants dans une indication thérapeutique (ASMR compris entre 1 et 4), son prix peut être supérieur à celui de ses concurrents. En revanche, si le médicament n’apporte rien de nouveau (AMSR de niveau 5), il ne sera admis au remboursement que s’il permet une économie dans le coût du traitement (donc seulement s’il est moins cher que les autres traitements existants).
En fonction du SMR et de la gravité de la pathologie traitée, la Commission de Transparence émet un avis sur l’opportunité de rembourser le médicament, et, le cas échéant, recommande un taux de prise en charge.
![]() L’inscription du médicament au remboursement est prévue pour 5 ans. Cependant, la Commission de Transparence peut à tout moment procéder à la réévaluation du SMR si des modifications interviennent dans des stratégies thérapeutiques.
L’inscription du médicament au remboursement est prévue pour 5 ans. Cependant, la Commission de Transparence peut à tout moment procéder à la réévaluation du SMR si des modifications interviennent dans des stratégies thérapeutiques.
L’avis de la Commission de Transparence est ensuite récupéré par la Commission d’évaluation économique et de santé publique (hébergée par la Haute Autorité de Santé). Cette commission réunit des professionnels de santé, des économistes et des représentants des malades et des usagers. Elle doit rendre un avis sur le rapport coût/efficacité du produit. L’avis qui est rendu est un avis d’"efficience" qui se mesure essentiellement en "années de vie en bonne santé". Cet indicateur est un ratio entre le coût et l’efficacité du médicament exprimé en euro par QALY (Quality Ajusted Life Year : années de vie en bonne santé). L’avis d’efficience est complété par des indicateurs éthiques rendus sur la base d’un dossier fourni par le laboratoire.
Enfin, grâce à ses différents avis, le prix du médicament sera établi par le Comité économique des produits de santé (CEPS) sous l’autorité des ministères de la Santé et de l’Économie. Il est composé de hauts fonctionnaires des deux ministères, des représentants de la Caisse Nationale d’Assurance Maladie et des mutuelles. L’industrie pharmaceutique n’y siège pas.
Le prix est fixé par le CEPS après négociation avec le laboratoire fabricant le médicament. Ce prix dépend :
- de l’avis de la Haute Autorité de Santé sur l’efficience et l’ASMR,
- du prix des médicaments à même visée thérapeutique,
- des volumes de ventes envisagés,
- de la population cible,
- des prix pratiqués à l’étranger : le CEPS est soumis au "comparateur de prix européen" qui est une disposition par laquelle il s’oblige à fixer un prix similaire à ceux pratiquées au Royaume-Uni, en Allemagne, en Italie et en Espagne. Le prix du médicament ne peut être inférieur aux prix pratiqués dans ces quatre pays.
![]() Pourquoi le prix des médicaments remboursables est-il régulé ? La consommation de médicament étant à peu près stable, quel que soit le prix en vigueur, la régulation vise à atténuer l’effet de l’Assurance maladie sur le prix des médicaments. En effet, comme la consommation ne va pas dépendre (ou très peu) du prix des médicaments, les laboratoires pourraient en profiter pour imposer des prix très élevés, et ainsi mettre en difficulté le système de l’Assurance maladie. C’est pour cela que le prix des médicaments remboursables est régulé.
Pourquoi le prix des médicaments remboursables est-il régulé ? La consommation de médicament étant à peu près stable, quel que soit le prix en vigueur, la régulation vise à atténuer l’effet de l’Assurance maladie sur le prix des médicaments. En effet, comme la consommation ne va pas dépendre (ou très peu) du prix des médicaments, les laboratoires pourraient en profiter pour imposer des prix très élevés, et ainsi mettre en difficulté le système de l’Assurance maladie. C’est pour cela que le prix des médicaments remboursables est régulé.
Le prix ainsi fixé par convention entre le laboratoire et le CEPS est protégé pendant 5 ans. Le délai maximal de fixation du prix pour l’inscription d’un nouveau médicament est de 180 jours.
![]() Pour les médicaments disposant d’une autorisation temporaire d’utilisation, le laboratoire est libre de fixer son prix (nommé alors « indemnité ») en attendant que le processus d’autorisation de mise sur le marché soit parvenu à son terme. Les médicaments bénéficiant d’une ATU sont pris en charge à 100 % par l’Assurance maladie.
Pour les médicaments disposant d’une autorisation temporaire d’utilisation, le laboratoire est libre de fixer son prix (nommé alors « indemnité ») en attendant que le processus d’autorisation de mise sur le marché soit parvenu à son terme. Les médicaments bénéficiant d’une ATU sont pris en charge à 100 % par l’Assurance maladie.
Le taux de remboursement des médicaments sera établi par l’Union Nationale des Caisses d’Assurance Maladie (UNCAM). Le taux de remboursement est fixé en se basant sur le service médical rendu et la gravité de l’affection concernée.
![]() L’information sur les prix et le taux de remboursement des médicaments remboursables sont accessible dans les officines, ou bien sur la base de données publique des médicaments, ou encore en téléchargeant l’application médicaments.gouv.fr en flashant le code figurant sur la boîte du médicament.
L’information sur les prix et le taux de remboursement des médicaments remboursables sont accessible dans les officines, ou bien sur la base de données publique des médicaments, ou encore en téléchargeant l’application médicaments.gouv.fr en flashant le code figurant sur la boîte du médicament.
3.3 – Le prix des médicaments génériques
Le princeps est initialement protégé par un brevet pour une durée moyenne de 15 ans. Ensuite il passe dans le domaine public, et donc d’autres laboratoires peuvent en copier la formule et commercialiser le médicament générique correspondant, sans avoir à supporter les coûts de recherche initiaux. Cela leur permet de vendre le médicament générique a un prix bien moins élevé que celui du princeps.
Lors de la mise sur le marché du générique, le prix fabricant hors taxes du médicament est fixé en appliquant une décote de 60 % par rapport au prix du princeps. Parallèlement, le prix du princeps est lui-même diminué de 20 % (de plus, le titulaire peut également décider de baisser le prix davantage pour éviter d’être trop concurrencé par le prix du médicament générique).
Après 18 mois d’exploitation du médicament générique, le CEPS a le choix entre :
- appliquer un "Tarif forfaitaire de responsabilité" : c’est-à-dire de rembourser le princeps sur la base du prix du médicament générique,
- ou de baisser encore davantage le prix du princeps (- 12,5 %) et du générique (- 7 %).
![]() Les médicaments génériques ont permis d’économiser 3,2 milliards d’euros en 2018 et près de 27 milliards d’euros depuis 2000.
Les médicaments génériques ont permis d’économiser 3,2 milliards d’euros en 2018 et près de 27 milliards d’euros depuis 2000.
3.4 – Les marges des grossistes et des pharmacies, et les taxes
Après la fixation du prix fabricant hors taxes, une marge est appliquée pour rémunérer les grossistes et les répartiteurs, ainsi que les officines. Ces marges sont définies et encadrées par l’État par arrêté.
Pour les grossistes-répartiteurs, les marges sont définies par l’arrêté du 26 décembre 2011 modifiant l'arrêté du 4 août 1987 relatif aux prix et aux marges des médicaments remboursables et des vaccins et des allergènes préparés spécialement pour un individu. La marge correspond à 6,68 % du prix fabricant hors taxes avec un minimum de 30 centimes et un maximum de 30,06 €.
Pour les pharmacies, les marges sont définies par l’arrêté du 12 novembre 2018 modifiant l'arrêté du 4 août 1987 relatif aux prix et aux marges des médicaments remboursables et des vaccins et des allergènes préparés spécialement pour un individu. Les marges sont composées d’une part forfaitaire (honoraire à la boîte de 1,02 € quel que soit le médicament, c’est ce qu’on appelle l’honoraire de dispensation) et d’une part variable en fonction du prix du médicament définie de la façon suivante :
Le taux de TVA sur les médicaments remboursables est de 2,1 %.
3.5 – Schéma récapitulatif du circuit administratif d’un médicament
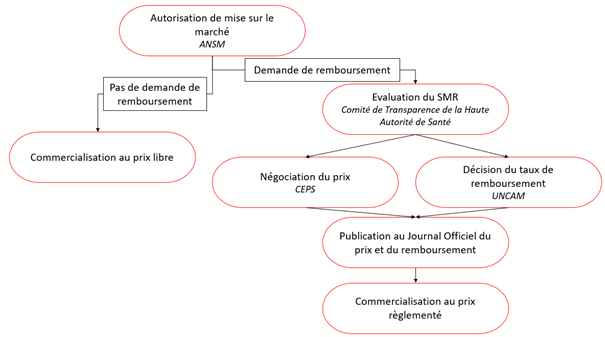
Graphique : INC
3.6 – La décomposition du prix public d’un médicament
Ainsi, le prix d’un médicament va se décomposer de la façon suivante :
- le prix fabricant hors taxes (PFHT) fixé par convention entre le laboratoire et le CEPS ;
- la marge du grossiste-répartiteur ;
- la marge du pharmacien ;
- la TVA.
En 2019, selon le rapport d’activité du CEPS, le prix moyen d’une boîte de médicament est de 10,31 € dont :
Graphique INC selon les données du rapport d’activité 2019 du CEPS
Ainsi, le prix fabricant hors taxes représente 76 % du prix d’une boîte de médicament, les marges (grossistes + pharmaciens) représentent en moyenne 22 % du prix, et la TVA environ 2 %.
4 – Où acheter ses médicaments ?
Une fois que le laboratoire a obtenu l’autorisation de mise sur le marché, il peut commercialiser le médicament à un prix libre ou un prix règlementé dans le cas d’une demande de remboursement pas l’Assurance maladie.
Ensuite, les laboratoires vendent les médicaments soit pour une utilisation à l’hôpital, soit pour une utilisation en ville (c’est-à-dire disponibles en vente dans les pharmacies). Pour le dernier cas, la vente se fait soit directement aux officines, soit par l’intermédiaire de grossistes-répartiteurs.
Selon le bilan économique 2019 du LEEM, les canaux de distribution des médicaments sont répartis de la façon suivante (en pourcentage du chiffre d’affaires réalisé) :
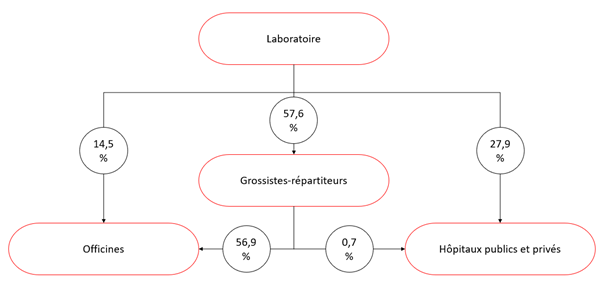
Graphique INC selon les données du LEEM
Pour le consommateur désirant obtenir des médicaments nécessitant une prescription médicale, donc avec une ordonnance, il ne peut se rendre que dans une pharmacie. En ce qui concerne l’achat de médicaments non remboursables et non soumis à une prescription médicale, le consommateur a le choix de se rendre en pharmacie ou alors il peut acheter ses médicaments en ligne.
![]() Le prix des médicaments en accès libre (et donc non remboursables) peut varier fortement d’une pharmacie à l’autre. Si vous en avez la possibilité, n’hésitez pas à comparer les prix pratiqués dans les pharmacies autour de chez vous.
Le prix des médicaments en accès libre (et donc non remboursables) peut varier fortement d’une pharmacie à l’autre. Si vous en avez la possibilité, n’hésitez pas à comparer les prix pratiqués dans les pharmacies autour de chez vous.
La vente en ligne de médicament sans ordonnance est encadrée par l’arrêté du 20 juin 2013 relatif aux bonnes pratiques de dispensation des médicaments par voie électronique. Cet arrêté dispose que :
Seules les pharmacies titulaires d'une officine physique peuveut ouvrir un site internet et uniquement après y avoir été aurotisées par leur Autorité régionale de santé (ARS). un logo européen attestant l'agrément de la pharmacies doit apparaître sur chaque page du site internet (logo et liste des sites autorisés consultables sur le site de l'Ordre national des pharmaciens, rubrique " Vente de médicaments sur Internet en France") :
- un questionnaire doit être rempli par l’acheteur avant la validation de sa commande concernant son état de santé (âge, poids, maladie, grossesse, etc.). Le but étant de vérifier que les médicaments commandés ne sont pas incompatibles avec l’état de santé général du patient,
- les commandes doivent être préparées dans les locaux de la pharmacie, sous la responsabilité des pharmaciens,
- al consultation des notices d’utilisation des médicaments est obligatoire par l’acheteur.
![]() La vente en ligne présente plusieurs avantages : les médicaments sont souvent moins chers et il est plus facile de comparer les prix entre les différentes pharmacies. Cependant, soyez attentifs aux frais de port qui peuvent parfois être importants. De plus, vérifiez que le site que vous consultez respecte bien les règles de vente en ligne de médicaments. Méfiez-vous des contrefaçons.
La vente en ligne présente plusieurs avantages : les médicaments sont souvent moins chers et il est plus facile de comparer les prix entre les différentes pharmacies. Cependant, soyez attentifs aux frais de port qui peuvent parfois être importants. De plus, vérifiez que le site que vous consultez respecte bien les règles de vente en ligne de médicaments. Méfiez-vous des contrefaçons.
En avril 2019, l’association Familles Rurales a réalisé un observatoire des prix des médicaments. Voici les principaux enseignements tirés de cette étude :
- l’information au consommateur est défaillante concernant les prix des médicaments en accès libre : les prix ne sont généralement pas affichés sur les boîtes, ce qui empêche le consommateur de connaître ce qu’il va payer avant de passer en caisse. De plus, seuls 39 % des pharmaciens délivrent un ticket de caisse, ce qui renforce le manque de transparence concernant les prix,
- les règles de la vente en ligne ne sont pas toujours respectées : 30 % des sites internet ne proposent pas le questionnaire sur l’état de santé de l’acheteur, 46 % des sites n’exigent pas toujours la consultation de la notice d’utilisation sur l’ensemble des médicaments proposés, 14 % des sites n’affichent pas le logo européen attestant de leur agrémentation. De manière générale, ils soulignent que 10 % des sites consultés ne sont pas conforme au règlement général sur la protection des données personnelles.
![]() Pour connaitre les règles relatives à l’information des consommateurs sur les prix, vous pouvez consulter :
Pour connaitre les règles relatives à l’information des consommateurs sur les prix, vous pouvez consulter :
- La fiche pratique de l'INC " L'information sur les prix pour certains biens et services "
- La fiche " Prix : rappel des règles d'étiquetage en office " sur l'Ordre national des pharmaciens
![]()
- La vidéo Consomag "Comment trouver le meilleur prix des médicaments ?"
- La vidéo Consomag "Que faire des médicaments périmés ou non utilisés ?"
- La vidéo Consomag "Achat de médicaments sur internet : attention à la contrefaçon"
- L’enquête sur l’information du consommateur sur le prix des médicaments vendus en pharmacie de la DGCCRF
- Le site de l’Agence nationale de sécurité du médicament et des produits de santé
Sophie Rémond
Économiste à l’Institut National de la Consommation








